Podemos considerar a los virus paquetes de información genética que codifican las proteínas necesarias para realizar su ciclo infeccioso. Pero esto no es así, ya que los virus no disponen ni codifican en sus genes la maquinaria bioquímica de síntesis de energía, división o diferenciación que definen las funciones celulares. Para esto necesitan parasitar la célula infectada y utilizar sus factorías para replicarse y generar una progenie infecciosa. El genoma del VIH codifica nueve proteínas pero necesita más de mil para infectar la célula y realizar su ciclo biológico completo.
En 2008 distintos autores caracterizaron las proteínas celulares necesarias para permitir la replicación del VIH y entre las pocas proteínas que fueron comunes a todos los estudios destacaba la Transportina 3 (TNPO3). La TNPO3 es una importina que introduce en el núcleo proteínas celulares que actúan sobre al ADN, especialmente factores de procesamiento del ARN mensajero. En estos trabajos se demostró que el “apagado” del gen de la TNPO3 originaba una resistencia absoluta a la infección por el VIH.
En 2013 dos trabajos identificaron una mutación en el gen de la TNPO3 como la causa de una enfermedad muscular ultra-rara denominada “Limb girdle muscle disease type 1F” (LGMD1F). La mutación origina una deleción en el codón STOP del gen por lo que se prolonga la lectura del ADN hasta el siguiente codón STOP en la secuencia, lo que genera una “cola” de 15 aminoácidos en la región carboxi-terminal de la proteína. Al tener esta enfermedad un carácter dominante, los pacientes expresan un 50% de TNPO3 normal (TNPO3wt) y un 50% de la forma mutante (TNPO3mut).
Como hemos mencionado, el papel funcional de la TNPO3 es importar al núcleo proteínas celulares entre las que destacan factores de splicing o procesamiento del ARN mensajero, como son CPSF6 y Sc35. Estos factores regulan la expresión de proteínas como la Tropomiosina, una proteína que participa en la contracción muscular, por lo que pensamos que, debido a esta deficiencia en el transporte de factores de splicing, algunas proteínas musculares no son producidas en su conformación correcta y esto provocaría el daño muscular. De hecho, en el artículo se describe cómo en las células de los pacientes el factor CPSF6 se queda parcialmente en el citosol cuando la localización es 100% nuclear en los individuos sanos.
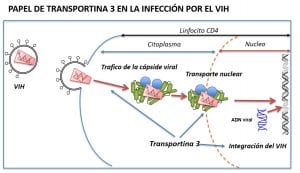
A partir de estos datos, y en relación con el VIH, la hipótesis planteada pretendía demostrar si los linfocitos CD4 de los pacientes con esta rara enfermedad muscular son resistentes a la infección por el virus del SIDA al tener una forma anormal de TNPO3. En caso de confirmarse esta hipótesis, esta mutación en TNPO3 se convertiría en la segunda mutación génica descrita que impide la infección por el VIH. Existe el precedente de una mutación en el gen CCR5, que participa en algunos procesos inmunes, lo cual genera una proteína anormal debido a que carece de 32 aminoácidos en su secuencia. La mutación de CCR5 en homocigosis confiere una resistencia completa a la infección por variantes del VIH que utilizan este receptor para entrar en la célula, algo que sucede en más del 98% de las variantes del virus.
Los resultados publicados en la revista Plos Pathogens demuestran que los linfocitos CD4 de la mayoría de los pacientes con LGMD1F son altamente resistentes (>90%) a la infección. Inicialmente no pensamos que la resistencia sería tan elevada al tener un 50% de proteína normal. Trabajos muy recientes muestran que la TNPO3 nativa puede asociarse consigo misma formando dímeros y en el laboratorio hemos demostrado que la proteína mutante puede formar dímeros con la proteína normal. Por este motivo, actualmente trabajamos sobre la hipótesis de que la proteína mutante se une a la normal y altera su función como ocurre, por ejemplo, con los priones o formas anómalas de amiloide. Confirmar este dato es importante porque nos permitiría diseñar fármacos que impidan esta interacción TNPO3wt/TNPO3mut para permitir la formación de dímeros normales de TNPO3wt/TNPO3wt, frenando así la progresión de la enfermedad.
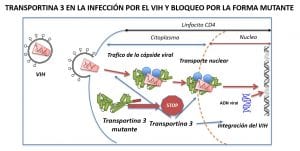
El segundo aspecto destacable del trabajo publicado es la caracterización del mecanismo de resistencia a la infección por VIH. La TNPO3 interacciona con la cápside y la integrasa virales y actúa en el ciclo del VIH a distintos niveles: la interacción TNPO3-cápside le permite desplazarse en el citosol, llegar al poro nuclear y entrar en el núcleo. La interacción con la integrasa le permite integrarse en el ADN celular. Por todo ello, es posible que la mutación en TNPO3 pueda crear cuellos de botella en todos los pasos: llega menos cápside al poro nuclear y entra menos virus en el núcleo, pero el paso decisivo es que altera la integración del genoma viral en el ADN de la célula infectada.
Seguimos trabajando para identificar nuevas estrategias terapéuticas mediante el diseño de fármacos o terapia génica que nos permitan inhibir de manera selectiva las interacciones TNPO3wt/TNPO3mut con el fin de mejorar la enfermedad muscular, así como para identificar fármacos que bloqueen la interacción de la cápside o la integrasa con la TNPO3wt para así bloquear el ciclo infeccioso del VIH.
Sara Rodriguez-Mora, post-doc del grupo lo ha hecho posible con el apoyo de toda la Unidad de Inmunopatología del SIDA del instituto de Salud Carlos III. El proyecto nos ha permitido conocer y trabajar con grupos de especialistas en enfermedades raras como el de Juan Vílchez en el Hospital de La de valencia Fe o de Rubén Artero en la Universidad de Valencia. Pero, sobre todo, el proyecto nos compromete con los pacientes que nos han dado todo su apoyo desde el principio. No sólo donando su sangre para los estudios que publicamos, sino financiando ellos mismos la investigación a través de la Asociación “Conquistando Escalones”.
Para nuestro grupo, este es un trabajo científicamente fascinante que nos sitúa en la investigación de frontera, entre disciplinas muy diferentes. Pero también es un ejemplo de cómo las fronteras en ciencia se difuminan y una enfermedad tan rara y olvidada como la LGMD1F ayuda a comprender otra enfermedad “celebrity” como es el SIDA y que el desarrollo de nuevos tratamientos frente a dos enfermedades tan distintas viajan juntos a bordo de la TNPO3.
Mayte Coiras, José Alcamí. Unidad de inmunopatología del SIDA, Instituto de Salud Carlos III
Artículos relacionados: SIDA, distrofia muscular de cinturas autosómica dominante tipo 1F, tratamiento, transportina 3,
Fuente: http://bit.ly/2lJ6LLk








